La declaración Prisma fue creado en julio de 2009 por 29 autores, y tiene como objetivo principal traer herramientas para el proceso de transparencia en las publicaciones de las revisiones sistemáticas y metaanálisis. Presenta un documento con una lista de verificación con 27 items y un diagrama de flujo que buscan una claridad de las publicaciones y un intento de aumentar la extensión de las revisiones sistemática debido su gran importancia para generación de conocimiento para la atención a la salud.
Seguí leyendo “¿Qué es PRISMA?”¿Qué es PubMed Clinical Queries? ¿De qué se trata? ¿Cómo se utiliza?
Objetivo educativo:
Las consultas hechas en Pubmed Clinical Queries son para las investigaciones clínicas. Para hablarles a respecto de ese tema, vamos hacer un pequeño enfoque en como empezar a utilizar el pubmed. El Objetivo de ese trabajo es aportar datos a respecto de como utilizar la opción Pubmed Clinical Queries, mostrarles las opciones que presenta y cual su funcion para que asi les pueda ayudar en sus próximas busquedas que sean de caracter clinico.
Desarrollo del tema:
En la Biblioteca Nacional de Medicina em EE.UU ( NLM ) se puede encontrar los aportes informativos mas actualizados del momento; tornandose asi la más grande base de datos. El Pubmed es la fuente de busqueda en el NLM, teniendo el MEDLINE como principal contenido informativo. Es de fácil acceso, gratuito , siendo necessário el uso de internet. En Medline los artículos científicos se basan en temas médicos, con el uso de los términos “ mesh ‘’ (1)
Es simple accesar a los contenidos literários de Pubmed; tenés que escribir el tema o el titulo del articulo que tenes interes de leer donde dice “ Search Pubmed “ y hacer click donde dice “ Search “ . Asi van a tener una amplia cantidad de bibliografias pero que no tienen filtro, lo que les va a costar mas tiempo hasta encontrar el articulo que desean. Por lo tanto, es importante que sepan utilizar herramientas simples y básicas, como los términos MESH ( Medical Sujected Headings) , Clinical Queries y los operadores Booleanos los que les van a servir como filtros, ayudando a ahorrar tiempo y les brindando una informacion mas precisa del asunto. (2)
Lo recomendable es que inicie su computadora y abra la base de datos de Pubmed en Internet. Una forma fácil es buscar Pubmed em google. La sigla NIH y el titulo National Center for Biotchenology Information estan en la parte superior izquierda de la pagina en las ventanas abiertas en la computadora. (3)
Cuando haces su busqueda y hace el click en “ Advanced “ les va a llevar a la ventana donde dice “ historial “ y ahi vas a poder tener acceso a las busquedas que hayas heco con los detalles y los números que estan em azul son las referencias.(4)
- TÉRMINOS MESH ( MEDICAL SUBJECT HEADINGS )
Esa opcion esta ubicada en la parte inferior derecha de la pagina principal de Pubmed. Hay una columna con el titulo “ Explore’’ ahí un poquito mas abajo esta la herramienta “ Mesh Database “. Cuando hagas “ click ‘’ le va llevar a una nueva pagina donde vas a poner la palavra de interes y te mostrara los términos mesh. Esos términos presentan palavras sinónimas los que presentaran el mismo Mesh uma vez hecha la busqueda.(2)
Los “ Mesh “ son palavras desarrolladas por la NLM para ser utilizada como herramienta en la busqueda de informaciones mas importantes y relevantes. Siendo así una manera especial en la busqueda. Todas las literaturas contenidas en Medline presentan una lista de eses términos. Cuando se objetiva la presencia de asterisco ( * ) luego de un mesh quiere decir que ese es el tema principal del articulo. (1)
- OPERADORES BOOLEANOS
Son los que le van ayudar a relacionar sus palavras claves en pubmed y asi hacer una busqueda mas puntual, hacen combinaciones lógicas. Los más utilizados son: AND, OR y NOT ; se los debe poner con letras mayusculas.(5)
Al poner AND entre dos palavras, es lo mismo que esta pidiendo que en la busqueda contenga las dos cosas en comun; lo que quiere decir que los artículos que presenten uno de los temas pero no los dos no seran puestos. (5)
Al poner OR lo que hace es combinar los conceptos puestos, lo que quiere decir que si su primer palavra presenta 10 articulos y el segundo 20 articulos la busqueda se resultara en 30 articulos para leer. (5)
Al poner NOT lo que hace es eliminar un termino puesto en la busqueda. Asi que hay que tener cuidado al utilizarlo para que no dejes de tener acceso a algun documento que sea de su interes. (5)
- PUBMED CLINICAL QUERIES
El Pubmed tiene como característica presentar una base de datos especificamente para consultas clinicas de una forma mas calificada y eficiente. Es fácil tener acceso a esa opcion de busqueda, esta ubicada en la parte inferior de la pagina principal, donde dice “ find “ y mas a abajo tenes la opcion “ clinical queries “(5)
Cuando haces click en esa opcion, te va a llevar a una pagina donde hay filtros que le van a ayudar a hacer una busqueda mas eficaz y rápida, con informaciones clinicas consideradas mas importantes, resultando mas simple el uso de esa base de datos. (5)
Estos filtros van a estar separados en columnas donde van a tener como títulos:
“ Clinical Study Categories” , “ Systematic Rewies “ y “ Medical Genetics “.
Donde dice “ Clinical Study Categories “ el enfoque es en los ensayos clínicos. Una vez que haya puesto su titulo o palabra principal en la caja de busqueda, va a surgir una nueva pagina con un cuadro para que aquella persona que estea buscando identifique si quiere informaciones a respecto de etiologia, pronostico, diagnostico, terapia y guias de prediccion clinica. Tambien hay un outro cuadro para que la persona elija si quiera algo mas amplio ( que seria presentar estúdio de casos, con diseños) o estrecho ( que presenta especificidade en los ensayos clínicos de manera mas aleatória ).(5)
“ Systematic Rewies “ tiene como funcion buscar informaciones sobre el titulo que tenga interes el usuário. Va haber uma classificacion: Metanalisis, revision sistemática, guia de practica clinica. Es muy parecida como cuando haces uma busqueda general em Pubmed y pones los filtros ubicados en la parte inferior izquierda de la pagina. Aunque esa opcion sea mas especifica si el usuário busca mas puntual acerca de uma revision literária, por ejemplo.(5)
Donde hay “ Medical Genetics “ como el próprio nombre dice, les va presentar filtros a respecto de genética como : Genetica molecular, asesoramiento genético, pruebas, descripciones clinicas, diagnósticos, diagnósticos diferenciales y administracion.
Referencias:
Aquí debe enumerar la bibliografía utilizada.
1. Theander SS. The use of PubMed/Medline in psychiatry. 1: Presentation of NLM and PubMed. Nord J Psychiatry. 2006;60(4):299–304.
2. David A, Manuel TE. MeSH y Operadores Booleanos. 2018;(October).
3. Theander SS. The use of PubMed/Medline in psychiatry. 2: The PubMed search window: A description and a tutorial. Nord J Psychiatry. 2006;60(4):305–9.
4. Theander SS. The use of PubMed/Medline in psychiatry. 3: Searching PubMed. Nord J Psychiatry. 2006;60(4):310–5.
5. Lindsey WT, Olin BR. PubMed searches: Overview and strategies for clinicians. Nutr Clin Pract. 2013;28(2):165–76.
Recordatorios Importantes: (Puede borrar este apartado de su artículo al terminar)
- La actividad esta planeada para una duración total de 7 días que se cuentan desde el 27/4/2020 (Día que se reanuda la cursada), sin embargo les sugerimos comenzar ahora en la medida de lo posible.
- Cada alumno deberá escribir un artículo sobe un tema de Investigación y temas aledaños (Incluye Metodología, Bioestadística, Lectura crítica de bibliografía, Buscadores y Herramientas de publicación, etc).
- El Blog es cerrado y solo los docentes pueden verlo antes de su entrega de WordPress.
- La redacción del tema deberá ser lo suficientemente clara y entendible ya que al finalizar la actividad será evaluada (y con las correcciones pertinentes estarán disponibles para que el resto del alumnado pueda estudiar e inspirarse con su lectura).
- No tienen límite de extensión para el desarrollo del artículo.
¿Qué son los niveles de evidencia?
Objetivo educativo:
Actualmente existe varios sistemas de clasificación en el mundo para los niveles de evidencia y la fuerza de recomendación, por lo cual trae una gran inconsistencia para los desarrolladores de guías clínicas. Un gran número de investigadores utilizan el sistema GRADE para clasificar la calidad de evidencia disponible. Los niveles de evidencia provienen no solo la solidez del diseño del estudio sino también la veracidad de los resultados finales.
Desarrollo del tema:
El nivel o grado de evidencia clínica es un sistema jerarquizado, basado en las pruebas o estudios de investigación, que ayuda a los profesionales de la salud a valorar la fortaleza o solidez de la evidencia asociada a los resultados obtenidos de una estrategia terapéutica.
El BMJ (British Medical Journal, una revista médica publicada semanalmente en el Reino Unido por la Asociación Médica Británica) ha solicitado en sus “Instrucciones para los autores” en bmj.com que los autores de preferencia utilicen el sistema de evaluación y desarrollo de calificación (GRADE) para calificar la evidencia al presentar un artículo de guías clínicas.
GRADE tiene ventajas sobre los sistemas de calificación. Otros sistemas comparten algunas de estas ventajas, pero ninguno, aparte de GRADE, los combina a todos.
Ventajas de GRADE sobre otros sitemas:
El sistema GRADE presenta aspectos diferenciales que se pueden resumir en tres:
- Inicialmente categoriza los desenlaces de interés (ej. muerte) y su importancia relativa;
- Luego evalúa la calidad de la evidencia en cuatro categorías para cada uno de los desenlaces para obtener una calidad global de evidencia;
- Finalmente gradúa la fuerza de las recomendaciones en dos únicas categorías (recomendaciones fuertes o débiles).
En el caso concreto de las revisiones sistemáticas el sistema GRADE se ha adoptado por parte de la Colaboración Cochrane para evaluar la calidad de la evidencia de sus revisiones sistemáticas. Las ventajas de esta aproximación son:
- Está desarrollado por un grupo internacional y representativo de desarrolladores de guías clínicas de varias partes del mundo.
- Muestra conjuntamente la calidad de la evidencia y el grado de recomendación. Por ejemplo: mala calidad, mala recomendación.
- Hay una evaluación explícita de la importancia de los resultados de estrategias de manejo alternativas.
- Existen criterios claros para bajar y subir los puntajes de calidad de la evidencia.
- Existe un proceso transparente del paso de la evidencia a la recomendación.
- Hay un reconocimiento explícito de los valores y preferencias de los autores, lo que también pudiera ser una desventaja.
- Finalmente, se presenta una interpretación clara y pragmática de recomendación fuerte o débil para médicos, pacientes y autoridades.
Calidad de evidencia:
Los expertos clínicos y las organizaciones que ofrecen recomendaciones a la comunidad clínica a menudo han cometido errores como resultado de no tener suficientemente en cuenta la calidad de la evidencia. Durante una década, las organizaciones recomendaron que los médicos indicasen a las mujeres postmenopáusicas a utilizar la terapia de reemplazo hormonal. Muchos médicos de atención primaria aplicaron debidamente este consejo en sus prácticas.
La creencia de que dicha terapia disminuyó sustancialmente el riesgo cardiovascular de las mujeres impulsó esta recomendación. Si se hubiera aplicado un sistema riguroso de calificación de la calidad de la evidencia en ese momento, habría demostrado que debido a que los datos provenían de estudios observacionales con resultados inconsistentes, la evidencia de una reducción en el riesgo cardiovascular era de muy baja calidad. El reconocimiento de las limitaciones de la evidencia habría atenuado las recomendaciones. En última instancia, los ensayos controlados aleatorios han demostrado que la terapia de reemplazo hormonal no reduce el riesgo cardiovascular e incluso puede aumentarlo.
La atención insuficiente a la calidad de la evidencia pone en riesgo pautas y recomendaciones inapropiadas que pueden llevar a los médicos a actuar en detrimento de sus pacientes. Reconocer la calidad de la evidencia ayudará a prevenir errores.
Clasificación de los niveles de evidencia según GRADE:
El sistema GRADE clasifica la calidad de la evidencia en niveles: alta, moderada, baja y muy baja. Se presenta en la Tabla 1.
| Alta calidad | Es poco probable que la investigación adicional cambie nuestra confianza en la estimación del efecto. |
| Calidad moderada | Es probable que la investigación adicional tenga un impacto importante en nuestra confianza en la estimación del efecto y puede cambiar la estimación. |
| Baja calidad | Es muy probable que la investigación adicional tenga un impacto importante en nuestra confianza en la estimación del efecto y es probable que cambie la estimación. |
| Muy baja calidad | Cualquier estimación del efecto es muy incierta. |
La evidencia que proviene de estudios clínicos aleatorizados se presupone como de alta calidad, pero este nivel puede disminuir en función de:
- Limitaciones del estudio.
- Inconsistencia de los resultados.
- Evidencia indirecta.
- Imprecisión.
- Sesgo de reporte.
Existen además otros cinco factores que pueden justificar disminuir la calidad y otros tres que pueden justificar aumentar la calidad de la evidencia ( Tabla 2 ).
| Diseño de estudio | Calidad de la evidencia inicial | En ensayos clínicos, disminuir si | En estudios observacionales, aumentar solo si | Calidad del conjunto de la evidencia |
|---|---|---|---|---|
| Ensayos clínicos aleatorizados | Alta | Limitaciones en el diseño o la ejecución | Fuerza de asociación | Alta |
| – Importantes | – Fuerte | |||
| – Muy importantes | – Muy fuerte | |||
| Inconsistencia | Gradiente dosis-respuesta | Moderada | ||
| – Importante | – Presente | |||
| – Muy importante | Consideración de los posibles factores de confusión que: | |||
| Incertidumbre en que la evidencia sea directa | Baja | |||
| – Importante | – Habrían reducido el efecto | |||
| – Muy importante | – Sugerirían un efecto espurio si no hay efecto | |||
| Estudios observacionales | Baja | Imprecisión | Muy baja | |
| –Importante | ||||
| –Muy importante |
Fuerza de la recomendación:
Indica el grado en que se puede estar seguro de que la adhesión a la recomendación producirá beneficio o daño. Cuando los efectos deseados de la intervención claramente superan o no superan a los indeseados, la recomendación es fuerte. Por otro lado, si los efectos de la intervención son más dudosos, o si la calidad de la evidencia es baja, la recomendación es débil.
Además de la calidad de las pruebas, varios otros factores que afectan a si las recomendaciones son fuertes o débiles ( Tabla 3 ).
Factores que afectan la fuerza de una recomendación:
| Factor | Ejemplos de recomendaciones fuertes | Ejemplos de recomendaciones débiles. |
|---|---|---|
| Calidad de la evidencia | Muchos ensayos aleatorios de alta calidad han demostrado el beneficio de los esteroides inhalados en el asma. | Solo las series de casos han examinado la utilidad de la pleurodesis en el neumotórax |
| Incertidumbre sobre el equilibrio entre los efectos deseables e indeseables. | La aspirina en el infarto de miocardio reduce la mortalidad con una toxicidad, inconveniencia y costo mínimos | La warfarina en pacientes de bajo riesgo con fibrilación auricular produce una reducción pequeña del accidente cerebrovascular, pero aumenta el riesgo de sangrado e inconvenientes sustanciales |
| Incertidumbre o variabilidad en valores y preferencias | Los pacientes jóvenes con linfoma invariablemente asignarán un mayor valor a los efectos de la quimioterapia que prolongan la vida que a la toxicidad del tratamiento | Es posible que los pacientes mayores con linfoma no asignen un mayor valor a los efectos de la quimioterapia que prolongan la vida que a la toxicidad del tratamiento. |
| Incertidumbre sobre si la intervención representa un uso racional de los recursos | El bajo costo de la aspirina como profilaxis contra el accidente cerebrovascular en pacientes con ataques isquémicos transitorios | El alto costo del clopidogrel y de la combinación de dipiridamol y aspirina como profilaxis contra el accidente cerebrovascular en pacientes con ataques isquémicos transitorios. |
La fuerza de la recomendación se mueve en un continuo que va de fuertemente recomendado a fuertemente no recomendado, con las recomendaciones débiles alrededor de la ausencia de efecto.
Calidad global de la evidencia:
Cada recomendación depende de la evidencia sobre resultados identificados al hacer preguntas clínicas y considerado como importante para los pacientes. El sistema GRADE realiza una valoración global de la evidencia, esta valoración global expresa la confianza general que tenemos en los desenlaces de interés y corresponde al menor nivel de confianza de los desenlaces claves.
Así, si para responder una pregunta tenemos 3 desenlaces claves, 2 de ellos con una calidad alta y otro con calidad moderada, la calidad global de la evidencia será valorada como moderada. Una recomendación fuerte está sustentada con una confianza alta o moderada en las estimaciones del efecto para los desenlaces claves y una recomendación débil, en una confianza baja o muy baja.
Conclusión:
El sistema GRADE proporciona un enfoque integral, explícito, y metodología transparente para calificar la calidad de evidencia y solidez de las fuerzas de recomendaciones sobre el manejo de pacientes. No evaluar el nivel de evidencia, puede llevar a recomendaciones prejudiciales a los pacientes, por lo que las guías clínicas o recomendaciones debieran informar cuál es la calidad de la evidencia que sustenta la intervención, y si dichas recomendaciones son fuertes o débiles.
Referencias:
- Howard Balshema, *, Mark Helfanda,b , Holger J. Sch€unemannc , Andrew D. Oxmand , Regina Kunze , Jan Brozekc , Gunn E. Vistd , Yngve Falck-Ytterf , Joerg Meerpohlg,h , Susan Norrisi , Gordon H. Guyattc. 2011. GRADE guidelines: 3. Rating the quality of evidence. https://www.sciencedirect.com/science/article/abs/pii/S089543561000332X
- David Atkins1, Martin Eccles2, Signe Flottorp3, Gordon H Guyatt4,David Henry5, Suzanne Hill5, Alessandro Liberati6, Dianne O’Connell7,Andrew D Oxman3, Bob Phillips8, Holger Schünemann4,9, Tessa TanTorres Edejer10, Gunn E Vist*3, John W Williams Jr11 and The GRADE Working Group3. 2004. Systems for grading the quality of evidence and the strength of recommendations I: Critical appraisal of existing approaches The GRADE Working Group. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2335261/
- Daniela Pérsico T.1 y David Torres P.2. 2014. Niveles de evidencia y grados de recomendación: Sistema GRADE. https://revistachilenadeanestesia.cl/PII/revchilanestv43n04.18.pdf
- Andrea Juliana Sanabriaa, David Rigaua, Rafael Rotaecheb, Anna Selvaa, Mercè Marzo-Castillejoc y Pablo Alonso-Coelloa. 2015. Sistema GRADE: metodología para la realización de recomendaciones para la práctica clínica. https://www.sciencedirect.com/science/article/pii/S0212656714000493?via%3Dihub
- Luigi Terraccianoa, Jan Brozekb, Enrico Compalatic and Holger Schu¨nemann. 2010. GRADE system: new paradigm. https://journals.lww.com/co-allergy/Abstract/2010/08000/GRADE_system__new_paradigm.19.aspx
¿Qué es un estudio de pruebas diagnósticas? Principales características.
Objetivo:
El objetivo de este artículo, es tener un acercamiento más sencillo hacia la bio-estadística y a su vez brindar herramientas comprensibles, con el fin de entender ¿Que es una prueba diagnóstica? ¿Cuales son los lineamientos para la interpretación de la información estadística que nos ofrecen dichas pruebas? y lo mas interesante es la aplicación para posteriores investigaciones, ya que tenemos acceso a múltiples instrumentos susceptibles de exploración diaria en la medicina.
Introducción
Para hablar de una prueba diagnóstica primero tenemos que definir el término “diagnóstico” que hace referencia a recopilar datos, analizarlos y dar una interpretación de ellos, con el fin de evaluar una situación de salud-enfermedad de nuestro objeto de estudio. Según Hipócrates no hay un pronóstico correcto si no se hace un buen diagnóstico (1).
Para determinar qué una prueba es diagnóstica, tiene que ser susceptible de ser medida y por tanto, el uso de la observación o el tacto no corresponderían en la definición estricta; es así que el uso de los cinco sentidos no puede establecerse como prueba diagnóstica por sí misma, pero sí como un parámetro para la descripción de un signo que se pueda medir (presión arterial, rango de movilidad, saturación de oxígeno, frecuencia cardiaca, etc.) (2)
Los estudios de pruebas diagnósticas pertenecen al grupo de los estudios descriptivos y por lo general se basan en diseños transversales, proporcionando resultados que reflejan la realidad en un momento dado, es decir un visión estática de un grupo en un tiempo determinado.
En el ámbito de la salud, el uso de pruebas diagnósticas ha sido de uso cotidiano en los diferentes estudios, debido a los múltiples tratamientos que se pueden brindar como: farmacológico, quirúrgico, radioterápico, hormonal, trasplante de células, etc. Con el fin de tener un respuesta que tenga tanto efectividad como validez científica y terapéutica (3).
A continuación se expondrán características principales de las pruebas diagnósticas y cómo podemos hacer uso de ellas de manera más sencilla y didáctica posible. Para lograrlo nos haremos una serie de interrogantes que iremos exponiendo a lo largo del documento.
¿Cómo se evalúa una prueba diagnóstica?
Para poder evaluar una prueba diagnóstica es necesario recurrir a la validez y reproductibilidad de la misma y a su vez la obtención de valores predictivos, en el marco de una prueba gold standar o prueba de referencia para el cuestionamiento a resolver.
¿Entonces, qué se entiende por validez en el marco de una prueba diagnóstica?
Validez: La validez de una prueba en bioestadística hace referencia a que determinado experimento con determinadas características mida lo que tenga que medir, comparándolos con una prueba de referencia patrón. (4)
La validez a su vez se puede expresar matemáticamente hallando la sensibilidad, especificidad, valor predictivo positivo y valor predictivo negativo.
¿Qué es y cómo puedo hallar la sensibilidad especificidad, valor predictivo positivo y valor predictivo negativo de una prueba diagnóstica?
Sensibilidad: Es la capacidad de una prueba para detectar a los que verdaderamente están enfermos en el caso de salud- enfermedad; o de indicar los casos positivos según lo que evalué el experimento.
Especificidad: Es la capacidad de una prueba, en donde se evalúa un sujeto sano y esté sujeto de negativo en la prueba que se esté realizando.
Para poder entender un poco más sobre la sensibilidad y la especificidad, la estadística ha diseñado una tabla de 2×2 en donde cruzan los posibles resultados.
| ENFERMOS | NO ENFERMOS | TOTAL | |
| POSITIVOS | a | b | a+b |
| NEGATIVOS | c | d | c+d |
| TOTAL | a+c | b+d | a+b+c+d |
De acuerdo a una tabla de 2 × 2 podemos expresar que:
Sensibilidad = a/a+c
correspondiente a verdaderos positivos/verdaderos positivos + falsos negativos
Especificidad = d/b + d
correspondiente a verdaderos negativos/verdaderos negativos + falsos negativos.
Siendo (a+b+c+d) el total de individuos evaluados, (a+c) el total de enfermos, (b+d) el total de no enfermos al momento de realizar la prueba.
Valor predictivo positivo (VPP): representa la probabilidad de que un sujeto este enfermo ya que el resultado de la prueba fue positivo
VPP= a/ a+b
Valor predictivo negativo (VPN) indica la probabilidad de no tener enfermedad ya que la prueba fue negativa.
VPN= d/c+d
A su vez también podemos calcular los índices de error:
Proporción de falsos positivos (PFP)
PFP= c/a+c = 1- especificidad
Proporción de falsos negativos (PFN)
PFP= b/b+d =1- sensibilidad.
Y la prevalencia de la enfermedad se calcularía (a+c/a+b+c+d), siendo muy útil ya que nos muestra información sobre la prueba que se está realizando y sobre la población en estudio (5).
Para complementar lo anteriormente expuesto mire el siguiente vídeo.
¿Para qué me sirve la reproducibilidad de una prueba diagnóstica?
Entonces la reproducibilidades la capacidad de la prueba para ser reproducida por otros evaluadores, con la finalidad de comprobar la veracidad de la misma y me sirve para saber si lo puedo replicar con la población que estoy estudiando (4).
Matemáticamente existen otras formas de expresar los resultados y para eso se opta por exponer el cociente de probabilidad tanto positivo como negativo.
¿Qué es el cociente de probabilidad?
Es aquella que compara la probabilidad de conseguir un determinado resultado en un sujeto con la enfermedad, con la de obtenerlo en un sujeto en el que se ha descartado la presencia de la misma.
El cociente de probabilidad de una prueba positiva (CPP) se calcula dividiendo la proporción de casos positivos “sensibilidad” entre la proporción de sujetos que no poseen la enfermedad, los llamados falsos positivos, “1 – especificidad”.
CCP= Sensibilidad/1-Especificidad
El cociente de probabilidad de una prueba negativa (CPN) se calcula dividiendo la proporción de casos negativos “1- sensibilidad” entre la proporción de sujetos que no poseen la enfermedad, y que la prueba dio resultado negativo “especificidad”.
CPN= 1-Sensibilidad/Especificidad
Entonces de todo lo anteriormente dicho nos lleva a preguntarnos ¿Cómo se puede verificar si la prueba que estoy haciendo posee la validez suficiente?
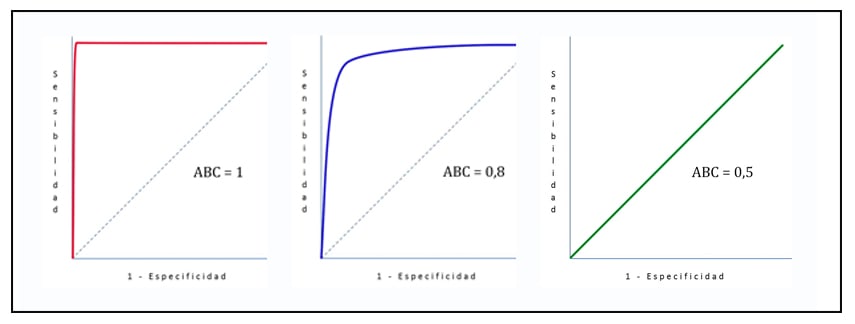
Para eso podemos explicarlo con la curva ROC (Característica operativa del receptor), la cual representa gráficamente la sensibilidad y la especificidad y su relación, derivados de los puntos de corte y sus variaciones en los rangos de los resultados mostrados en la prueba.
Los valores de área bajo la curva de ROC serán entre 0 y 1, esto garantiza la eficacia de la prueba realizada, a su vez certifica que la prueba hace una correcta diferenciación entre enfermos y no enfermos del experimento (6).
Referencias:
1. El diagnostico médico. Lorenzano, C. 2006, Subjetividad y procesos cognitivos, pág. 150.
2. Servicio de Epidemiología Santiago de Compostela. Pruebas diagnosticas. Pruebas diagnosticas. [En línea] 22 de febrero de 2006. https://www.sergas.es/Saude-publica/Documents.
3. Las pruebas diagnósticas. Su aplicación en los estudios epidemiologicos. Ávalos , O. 2000, Revista de nefrologia, Sociedad Española de Nefrología, pág. 403.
4. Unidad de Epidemiología Clínica y Bioestadística. investigación Pruebas diagnósticas. investigación Pruebas diagnósticas. [En línea] 14 de 07 de 2003. [Citado el: 21 de 04 de 2020.] www.mbe/investiga/pruebas_diagnosticas/pruebas_diagnosticas.
5. Pruebas diagnósticas: aspectos básicos de lo que el endoscopista debe saber. Duarte, A, Herrera, D y Téllez, F. 3, Ciudad de México : Elseiver, 2016, Vol. 28. 10.1016.
6. Peréz, I y Battikhi, B. Características de los test diagnósticos . Málaga : Ed Cont Lab Clín, 2017.
¿Qué es CONSORT?
Objetivo educativo:
El objetivo del presente artículo tiene como misión fundamental la orientación del lector al conocimiento de cómo un grupo de investigadores y editores realizaron un mejoramiento de la calidad en la comunicación de los ensayos clínicos controlados aleatorizados (ECCA) de grupos paralelos. Para ello se desarrolló la Declaración Original CONSORT (Consolidated Standards of Reporting Trials)
Desarrollo del tema:
La publicación de un Ensayo debe ser realizado mediante pautas que transmitan con claridad que conductas se utilizaron, como fue analizado y cuáles son las conclusiones a las que se arribaron. Es de fundamental importancia que se transmitan los métodos que fueron utilizados en la elaboración de dicho Ensayo ya que serán la base de la solidez y las limitaciones a las cuales se enfrenta el lector y, de esa manera, se evitaran interpretaciones inadecuadas.
Para ello, el Grupo Consort, desarrolló la Declaración Original CONSORT (Consolidated Standards of Reporting Trials) que tiene como base el uso de una lista de comprobación y un diagrama de flujo.
El Grupo CONSORT está formado por un grupo internacional de investigadores clínicos, estadísticos, epidemiólogos y editores biomédicos que son los que analiza, modifican o eliminan las distintas publicaciones que se envían, en función de esas pautas establecidas en la Declaración Consort 2010.
No se trata de un grupo estático, sino que es dinámico ya que se van incorporando nuevos integrantes, lo que significa un aporte de nuevas ideas y actualización constante.
Como ya se dijo anteriormente, la Declaración Consort consta de una lista de comprobación y un diagrama de flujo.
LISTA DE COMPROBACION
La lista de comprobación revisada consta de 25 puntos seleccionados, los cuales otorgan validez e importancia cuando la información es empírica y ayuda a los autores a mejorar la calidad de los informes de dos grupos paralelos simples. Los elementos de la lista de verificación se centran en informar cómo se diseñó, analizó e interpretó el ensayo.
La lista de comprobación se conforma de:
- Titulo
- Resumen
- Introducción
- Métodos
- Resultados
- Discusión
- Otra información
LISTA DE COMPROBACIÓN

–Lista de verificación de información CONSORT 2010 que se debe incluir al informar un ensayo aleatorio
DIAGRAMA DE FLUJO
El diagrama de flujo consta de los pasos a seguir por los participantes para elaborar un ECCA y muestra el progreso de los participantes a través de la prueba.
Un diagrama de flujo puede ser revisado y explícito.
Cuando es un diagrama de flujo revisado contemplará los 4 estadios (selección, distribución, seguimiento y análisis).
El diagrama explicito incluye el número de los participantes del grupo y el análisis de los datos.

–Diagrama de flujo del progreso a través de las fases de un ensayo aleatorio paralelo de dos grupo
La Declaración Consort que rige en la actualidad, es llamada Consort 2010.
La misma informa lo que se hizo y lo que se encontró, pero no recomienda la forma en que deben realizarse el diseño y análisis del ensayo. Sin embargo, podrían ayudar a realizar el ensayo.
Un concepto muy importante a tener en cuenta es la estricta revisión ética que realizan los organismos de financiación y las revistas médicas. La Declaración Consort 2010 aborda qué criterios mínimos deben ser tenidos en cuenta, aunque los autores pueden incluir otra información si la consideran importante, siempre basada en nueva evidencia metodológica y experiencia acumulada.
Investigaciones anteriores han identificado problemas metodológicos en el diseño y la realización de ensayos aleatorios que podrían, si no se abordan, dar lugar a resultados sesgados. Acorde a esto, se observa la importancia de la consideración del principio etico de equilibrio conocido como “principio de certidumbre”.
Atento a que estos lineamientos tienden a organizar sobre la base de lograr ese punto de equilibrio al cual aspira para una adecuada equidad en los razonamientos y las exposiciones de los ECCA, y para que los resultados de estos estudios se conviertan en la base de la atención médica basada en la evidencia, se deben gastar considerables energías y recursos en mejorar sus informes, ademas de todo el empeño que se manifiesta tanto en la labor de los investigadores y cientificos como en los que los realizan. Este es el objetivo de la Declaración Consort 2010 bajo la perspectiva de un mejoramiento continuo.
Referencias:
http://www.consort-statement.org/
BMJ 2010; 340: c332
Article (PDF Available)inPLoS ONE 10(5):e0128061 · May 2015 with 111 Reads DOI: 10.1371/journal.pone.0128061 · Source: PubMed
Chan AW, Altman DG. Epidemiology and reporting of randomised trials published in PubMed journals. Lancet. 2005;365(9465):1159–1162. doi:10.1016/S0140-6736(05)71879-1
Moher D, Schulz KF, Altman DG; CONSORT GROUP (Consolidated Standards of Reporting Trials). The CONSORT statement: revised recommendations for improving the quality of reports of parallel-group randomized trials. Ann Intern Med. 2001;134(8):657–662. doi:10.7326/0003-4819-134-8-200104170-00011
¿Qué es la Precisión y la Exactitud? ¿Para qué se utilizan? ¿Cómo se calculan?
Objetivo Educativo:
Este artículo tiene el objetivo de ayudar al alumno que necesite hacer un trabajo de final de carrera a entender los criterios relacionados con la exactitud y la precisión de un instrumento de medición , a fin de reducir los sesgos y promover mayor confiabilidad y validez de su estudio. En un trabajo de investigación, la integridad de los datos depende de la integridad del sistema de medición.
La precisión y la exactitud son términos que están relacionados entre si y que se refieren a la capacidad que tiene un instrumento o escala al momento de la medición de las variables. La medición tendrá mayor validez mientras más precisa y exacta sea. Si se obtiene resultados con poca variabilidad con un instrumento, se presume que este es más preciso. Ya la exactitud de un instrumento se relaciona a capacidad de obtener resultados verdaderos y libres de sesgos. (1)
La precisión en un estudio y su utilidad
Por definición la precisión es la cercanía de dos o más valores de varias mediciones entre sí. Hay más precisión mientras más cerca estén los valores de diferentes mediciones y eso tiene una grande influencia en la potencia de un estudio porque mientras más precisa sea la medida, mayor será la potencia estadística, o sea, la precisión aumenta la potencia para detectar defectos. (2)
La palabra clave aquí es reproducibilidad. Es así que se valora la precisión, con la reproducibilidad de mediciones repetidas y esto está relacionado con los llamados errores aleatorios. Algunas fuentes de errores aleatorios son: (3)
- Variabilidad del observador (incluye factores como escoger palabras en una entrevista o tener habilidad para usar un instrumento mecánico) (3)
- Variabilidad del sujeto (se debe a la variabilidad biológica intrínseca de los participantes en el estudio) (3)
- Variabilidad del instrumento (incluye factores ambientales cambiantes, el desgaste de los componentes mecánicos, entre otros) (3)
Un instrumento es confiable y preciso cuando las mediciones realizadas generen los mismos resultados en diferentes momentos, escenarios y poblaciones. Pero en la practica la confiabilidad se conjuga con otro concepto que es la validez, dando origen a diversos escenarios, desde mediciones válidas y confiables hasta aquellas que carecen de validez y de confiabilidad. (2)
Unos de los principios fundamentales de la precisión en un estudio es la confiabilidad, o consistencia de las mediciones. És necesario que los investigadores intenten reducir la cantidad de fuentes de potenciales errores relacionados con la medición de las variables para proporcionar una mayor confianza en los resultados. (2)
Existen cinco métodos que se pueden emplear para tratar de reducir al mínimo el error aleatorio y aumentar la precisión de las determinaciones de cualquier estudio: la normalización de los métodos de medida, la formación y certificación de los observadores, el perfeccionamiento de los instrumentos, la automatización de los instrumentos y por último, repetir las determinaciones. (5)
Para cada una de las mediciones del estudio, es el investigador que decide cuánto hincapié debe hacer en cada una de estas estrategias.
Como se calcula la precisión de un estudio
Se calcula a través de la proporción de verdaderos positivos contra todos los resultados positivos, tanto verdaderos positivos (VP), como falsos positivos (FP): (3)
La fórmula és:
Precision = VP/VP+FP
Ahora, cuando es necesario estimar la precisión de una población (estadísticos), esta se calcula a través de un intervalo de confianza (IC). (4)
IC es una medida de la precisión de los resultados de un estudio con la finalidad de establecer inferencias sobre la población estudiada. En ciencias de la salud se suele utilizar un intervalo de confianza de 95%, debido a que sólo es posible aceptar como máximo un 5% de error estándar en las afirmaciones. (4)
La fórmula del IC se compone de dos parámetros principales; el primero denominado (d ), diferencia entre dos medidas (proporciones, medias, medianas, entre otras) y (e ), el error estándar aceptado para esa diferencia bajo una curva normal con un valor de Z= 1.96. (4)
Por lo tanto, la fórmula en general és [d +/- 1.96(e)].
Para lo cual, el error estándar se obtiene mediante 2√p (1-p)/n, donde “p” representa a la proporción de sujetos con el evento estudiado y (1-p) a la diferencia de la unidad menos el valor de “p” que se divide entre el número de pacientes. (4)
Siempre que se trate de estudios donde se analicen diferencias entre dos o más grupos para medias, proporciones (%), riesgos relativos y también para calcular estimaciones de estudios de diagnóstico (sensibilidad, especificidad, valores predictivos positivos e índices de probabilidad), tratamiento, casos y controles, inclusive meta análisis, es necesario incluir el IC. (4)
Exactitud y su utilidad
Exactitud en una prueba diagnóstica se refiere al grado en que sus resultados coinciden con un parámetro de referencia claro y objetivo, o sea, la exactitud de una variable es el grado en que representa el valor verdadero y su utilidad para un estudio es aumentar la validez de las conclusiones. (4)
En las ciencias de la salud, se dice que la exactitud és la capacidad de una prueba diagnóstica para clasificar correctamente a los individuos en subgrupos clínicamente relevantes (enfermos y NO enfermos)”. (5)
La exactitud va a depender del error sistemático (sesgo); cuanto mayor sea el error, menos exacta será la variable. Los posibles sesgos son: (4)
Sesgo del observador: una deformación, consciente o inconsciente de la percepción o la notificación de la medida por el observador. (4)
Sesgo del instrumento: funcionamiento defectuoso de un instrumento mecánico. (4)
Sesgo del participante: la deformación de la medición por parte del participante en el estudio, por ejemplo, al notificar un suceso (sesgo de respuesta o de recuerdo). (4)
Como se calcula la exactitud en un estudio
A diferencia de la precisión, la exactitud de una medición se evalúa mejor comparándola (si posible) con algún criterio de referencia. (4)
De manera práctica, se calcula con la proporción de resultados verdaderos (positivos y negativos) entre el número total de casos examinados (verdaderos positivos, falsos positivos, verdaderos negativos, falsos negativos). Por lo tanto, la formula es: (5)
Exactitud= VP+VN/VP+FP+FN+VN
Para incrementar la exactitud de un estudio también es posible contar con estrategias parecidas a las utilizadas para determinar la precisión: normalización de los métodos de medición, formación y certificación de los observadores, perfeccionamiento de los instrumentos, automatización de los instrumentos, realización de medidas que no se perciban (es posible diseñar mediciones de las que no sea consciente el participante y así eliminar la posibilidad de que conscientemente introduzca sesgo en la variable), calibración del instrumento y enmascaramiento. (5)
La decisión del interés que se debe poner en aplicar cada una de estas estrategias, así como en el caso de la precisión, es del elección del investigador.
Referencias:
- Villasís-Keever MÁ, Márquez-González H, Zurita-Cruz JN, Miranda-Novales G, Escamilla-Núñez A. El protocolo de investigación VII. Validez y confi abilidad de las mediciones. Rev Alerg Mex. 2018;65(4):414-421
- Manterola, Carlos, Grande, Luis, Otzen, Tamara, García, Nayely, Salazar, Paulina, & Quiroz, Guissela. (2018). Confiabilidad, precisión o reproducibilidad de las mediciones. Métodos de valoración, utilidad y aplicaciones en la práctica clínica. Revista chilena de infectología, 35(6), 680-688. https://dx.doi.org/10.4067/S0716-10182018000600680
- Portillo, Jacobo Diaz. Guía Práctica del Curso de Bioestadística Aplicada las Ciencias de la Salud. Alcalá, Madrid: Instituto Nacional de Gestión Sanitaria.
- Arceo Díaz, José LuisManual de medicina basada en evidencias / José LuisArceo Diaz, José Manuel Ornelas Aguirre, Susana Dominguez Salcido. México : Editorial El Manual Moderno, 2010. xii, 192 p. : il. ; 23 cm. Incluye índice ISBN 978-607-448-054-2
- Hulley SB, Cummings SR. Planificación de las mediciones: precisión y exactitud. En: Diseño de la investigación clínica. Barcelona: Doyma, 1993; 35-46.